 2008 wurde in den USA das „ gestartet, um das
2008 wurde in den USA das „ gestartet, um das
Human Microbiome Project“
menschliche Mikrobiom zu identifizieren. „Mikrobiom“ bezeichnet alle Mikroorganismen, mit denen Menschen besiedelt sind. Durch diese Studie wissen wir nun viel mehr über die einzelnen Mikroorganismen und ihre Funktionen für den Erhalt unserer Gesundheit – auch über unsere genitale Gesundheit.
Viele Mikroorganismen, besonders aber die Bakterien, helfen unserem Organismus, lebenswichtige Funktionen auszuüben, zu denen auch Befruchtung, Schwangerschaft und Geburt zählen.
Wird aber das Mikrobiom, z.B. durch Umwelteinflüsse, im Gleichgewicht gestört, kann es Schaden nehmen und seine Aufgaben nicht mehr angemessen erfüllen. Das führt zu mikrobieller Fehlbesiedlung („Dysbiose“), die sich als eine Balancestörung zwischen Mensch und Mikroorganismen auffassen lässt.
Wir bieten Ihnen die innovative Bestimmungsanalyse „Next Generation Sequencing (NGS)“. Sie erkennt eine mögliche, individuelle Störung der Balance, wodurch Ihr Arzt/ Ihre Ärztin Sie gezielt behandeln kann.
 Gegenwärtig befinden wir uns bereits in der zweiten Phase des humanen Mikrobiom-Projektes (HMPi). In dieser Phase werden unterschiedliche Aspekte der Wechselwirkung zwischen Mikrobiom und Mensch untersucht. Dies geschieht durch die Vernetzung unterschiedlicher biologischer Systeme („multi-omics“) wie dem Immunsystem oder den Stoffwechselaktivitäten („metabolom“). Dabei werden klinische Daten über längere Zeiträume erhoben und neue Labormethoden und Computer-Technologien kommen zum Einsatz.
Gegenwärtig befinden wir uns bereits in der zweiten Phase des humanen Mikrobiom-Projektes (HMPi). In dieser Phase werden unterschiedliche Aspekte der Wechselwirkung zwischen Mikrobiom und Mensch untersucht. Dies geschieht durch die Vernetzung unterschiedlicher biologischer Systeme („multi-omics“) wie dem Immunsystem oder den Stoffwechselaktivitäten („metabolom“). Dabei werden klinische Daten über längere Zeiträume erhoben und neue Labormethoden und Computer-Technologien kommen zum Einsatz.
Ein Fokus des HMPi liegt dabei auf dem genitalen Mikrobiom und seiner Rolle für die Frauengesundheit und für Schwangerschaft und Geburt.
Schon seit langem ist bekannt, dass die Vagina mikrobiell besiedelt ist („vaginales Mikrobiom“). Dieses Mikrobiom wird von unterschiedlichen Faktoren beeinflusst: von den weiblichen Geschlechts-Hormonen und damit auch vom Lebensalter einer Frau ebenso wie von eigenen Verhaltensweisen wie etwa der Intimhygiene oder dem Rauchen.
In der reproduktiven Lebensphase der Frau („Prämenopause“) fördern die Hormone Progesteron und Östrogen die fast vollständige Besiedlung der Vagina mit sogenannten Laktobazillen. Diese sorgen für ein saures Scheidenmilieu (niedriger pH) durch die Bildung von Milchsäure und produzieren Abwehrstoffe gegen andere, besonders pathogene („krankheitsauslösende“), Mikroorganismen.
Durch moderne Bestimmungsmethoden („next-generation-sequencing“) lässt sich die Zusammensetzung des vaginalen Mikrobioms genau bestimmen. Dabei lassen sich fünf verschiedene Typen feststellen, sogenannte „community state types“ (CSTs). Vier davon werden durch bestimmte Lactobacillus dominiert, nämlich Lactobacillus crispatus (CST I), Lactobacillus gasseri (CST II), Lactobacillus iners (CST III) und Lactobacillus jensenii (CST V).
Eine Ausnahme stellt CST IV dar, der keinen größeren Anteil an Laktobazillen aufweist. Dieser besteht aus einer Mischung aus unterschiedlichen Mikroorganismen (wie Gardnerella, Atopobium oder Mobiluncus), die mit verschiedenen Krankheitsbildern vergesellschaftet sind, beispielsweise der bakteriellen Vaginose (BV).
Die Verteilung der unterschiedlichen Typen in der Bevölkerung hängt von verschiedenen Faktoren ab; sie ist auch abhängig von der ethnischen Zugehörigkeit. Unter den Europäern finden sich bei etwa 90 % der Frauen ein vaginales Mikrobiom, das durch Laktobazillen dominiert ist – dabei ist CST I am weitesten verbreitet (etwa die Hälfte). CST IV findet sich hingegen nur bei etwa 10 % der prämenopausalen Frauen.
Die „community state types“ gelten als relativ stabil und sind in der Lage, Störungen und Einwirkungen von außen auzubalancieren. Jedoch können sie sich auch über die Zeit verändern: besonders während der Menstruation kann es zu CST-Wechseln kommen, die sich aber zumeist wieder zurückbildet; während des Eisprunges hingegen ist die CST-Stabilität am höchsten.
Nach der Menopause, wenn kein Östrogen-Präparate genommen werden, verändert sich das vaginale Mikrobiom und es kommt zu einer Abnahme von Laktobazillen. Man findet dann zumeist einen CST IV, der noch Anteile von Laktobazillen aufweist.
Obgleich die weiblichen Geschlechtshormone einen Einfluss auf das Mikrobiom ausüben lässt sich ein solcher Einfluss für die hormonelle Schwangerschaftsverhütung („Pille“) nicht nachweisen.
Die Gebärmutter galt lange Zeit als frei von Mikroorganismen, jedoch wird zunehmend deutlich, dass auch dieses Organ mikrobiell besiedelt ist („endometriales Mikrobiom“), auch wenn die Keimdichte dort geringere ist als in der Vagina. Noch ist die Datenlage diesbezüglich nicht so ausgearbeitet wie zum vaginalen Mikrobiom, allerdings mehren sich die Studien zu diesem Thema:
Klar ist, dass sich endometriales und vaginales Mikrobiom bei den prämenopausalen Frauen voneinander unterscheiden können. Beim Mikrobiom der Gebärmutter lassen sich offensichtlich ebenfalls 5 Typen unterscheiden, wobei nur zwei Typen von Laktobazillen dominiert werden (Typ 1 und 5). Die übrigen Typen setzen sich sehr heterogen zusammen. Auch findet sich in der Gebärmutter ein anderer pH-Wert als in der Vagina: er ist höher und damit weniger sauer.
Vor über 10 Jahren wurde das Humane Mikrobiom Projekt (HMP) gestartet, mit dem Ziel der Identifizierung und Charakterisierung der Gesamtheit der Mikroorganismen, die mit dem Menschen in Verbindung stehen. Dadurch wissen wir in der Zwischenzeit viel über die einzelnen Mikroorganismen, ihre Funktion und Aufgabe für den Erhalt unserer Gesundheit. Das Mikrobiom interagiert mit dem menschlichen Organismus: es wirkt einerseits auf den Mensch ein, wird aber andererseits auch durch den menschlichen Körper reguliert.
Lange ist man davon ausgegangen, dass sich unser Körper und seine Funktionen eine in sich abgeschlossene Einheit bilden. Die zahlreichen identifizierten Mikroorganismen – Parasiten, Bakterien oder Viren – hat man vornehmlich auf ihre gesundheitsschädlichen (pathogene) Eigenschaften hin untersucht.
Diese helfen dem Organismus oftmals lebenswichtige Funktionen auszuüben, etwa bei der Verdauung unserer Nahrung oder im Rahmen der Weitergabe des Lebens, also bei Befruchtung, Schwangerschaft und Geburt. Diese Mikroorgansimen bezeichnet man als Symbionten.
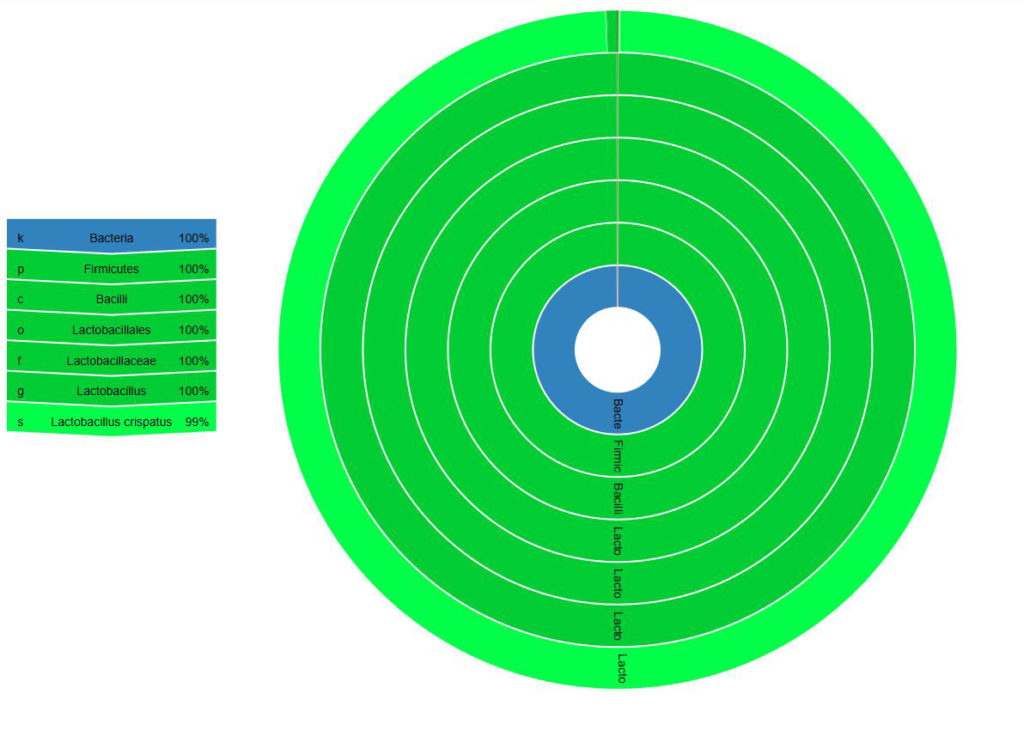
Abbildung 1: Homöostase
Mikrobiom-Analyse aus Vaginal-Abstrich. Das vaginale Mikrobiom setzt sich zu 100 % als Laktobazillen zusammen, davon ca. 99 % aus Lactobacillus crispatus. Unauffälliger Befund.
Beim Mikrobiom geht es immer um die Beschreibung einer Ganzheit, die als komplexes System funktioniert. Jedes System ist einmalig und einzigartig: es kann sich über die Zeit verändern und flexibel auf die Anforderung der Umwelt reagiert. In bestimmten Grenzen kann es sich dabei anpassen; werden die Grenzen überschritten, kann es jedoch Schaden nehmen und seine Aufgaben nicht mehr adäquat erfüllen. Dann kommt es zur mikrobiellen Fehlbesiedlung und Balance-Störung („Dysbiose“).
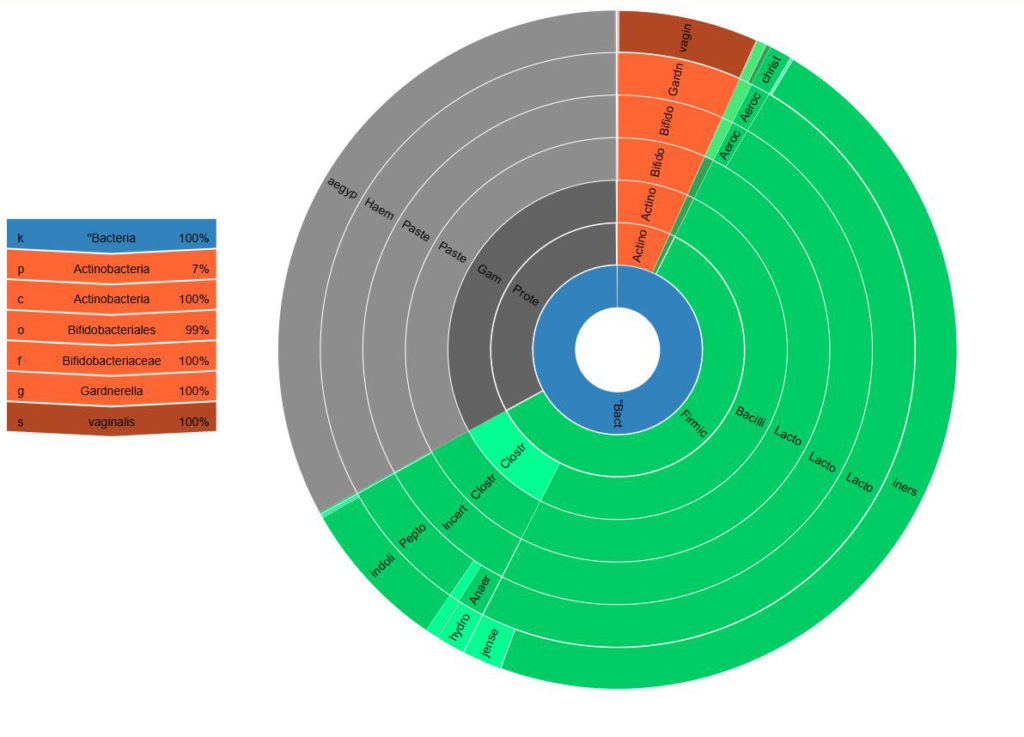
Abbildung 2: Dysbiose
Mikrobiom-Analyse aus Vaginal-Abstrich: das vaginal Mikrobiom setzt sich mehrheitlich aus Laktobazillen zusammen, jedoch weist Lactobacillus iners auf eine instabile Situation hin. Der Nachweis von Gardnerella vaginalis und Haemophilus sp. zeigt eine Dysbiose an.
Das vaginale Mikrobiom ist an komplikationsfreien Schwangerschaft ebenso beteiligt wie an der zeitgerechten Geburt. Auch die Fruchtbarkeit und Befruchtung – sei es auf natürlichem Wege oder durch künstlich unterstütz – hängt ganz wesentlich von der Zusammensetzung des genitalen Mikrobioms ab.
Das Laktobazillus-dominierte vaginale Mikrobiom unterstützt ein Abwehrsystem gegen Infektionen, um für einen gesunden äußeren und inneren Geschlechtstrakt zu sorgen. Vaginale Beschwerden, Ausfluss und Veränderung des Geruchs gehen meist mit einer Dysbiose einher.
Laktobazillen unterstützen ein Abwehrsystem gegen die Infektion mit humanen Papillomaviren (ttpv). Sie verhindern, dass sich Krebsvorstufen bilden, die sich zum Gebärmutterhalskrebs weiterentwickeln können.
Methodisch greift dus.ana auf die sogenannte „next-generation sequencing“(NGS)-Technologie zurück und arbeitet dafür mit einem großen Speziallabor in Düsseldorf zusammen. Dabei werden gezielt bakterielle Gene vervielfältigt und danach deren DNA-Sequenz bestimmt. Hochentwickelte Softwaresysteme erlauben dann die Zuordnung der einzelnen Sequenzen zu bestimmten Keimarten.
Erst die individuelle Einordnung der Mikrobiom-Analyse in die bestehende Klinik und Krankengeschichte erlaubt eine ärztlich relevante Befundung. Deshalb erfassen wir die Symptomatik und Behandlung ebenso wie die wesentlichen medizinischen Parameter, um eine wirklich personalisierte Diagnostik zu ermöglichen.
Auf die sich daraus ergebenden konkreten therapeutischen Optionen legen wir dabei größten Wert und befunden auch hier individuell.
Die Mikrobiom-Analyse erfasst eine Veränderung in der genitalen Besiedlung verschiedener Mikroorganismen („Dysbiose“). Einige der Fehlbesiedlungen gehen mit teils unangenehmen Beschwerden, aber auch schwerwiegenden Krankheitsbildern, einher.
An erster Stelle der zu behandelnden Dysbiosen steht die bakteriellen Vaginose (BV). Diese zeichnet sich durch grau-weißen Ausfluss („Fluor“), fischigen Geruch und einen ins basische verschobenen pH der Scheide (pH>4,4) aus. Im Mikroskop findet der Gynäkologe sogenannte „clue cells“ oder „Schlüsselzellen“, die die Krankheit anzeigen.
Behandelt wird im Allgemeinen nur die symptomatische BV. Je nach Befund oder Beschwerden ist der Einsatz von Antibiotika nicht immer zwingend und lässt Raum für andere Behandlungsformen; dabei stehen die Probiotika an erster Stelle, die auch zur gezielten Stabilisierung des genitalen Mikrobioms eingesetzt werden können. Auch Hormonpräparate und Substanzen, die den pH beeinflussen, kommen zum Einsatz.
Die antibiotische Behandlung der bakteriellen Vaginose (BV) ist heute weitgehend standardisiert [1]. Behandelt wird nur die symptomatische BV oder wenn eine gynäkologische oder geburtshilfliche Risikosituation vorliegt.
1. Wahl
Metronidazol (Tabletten) 2 x 500 mg oral für 7 Tage
Metronidazol (0,75% Gel) 1 x 5 g intravaginal für 5 Tage
Clindamycin (2% Creme) 1 x 5 g intravaginal für 7 Tage
Alternativ
Tinidazol (Tabletten) 1 x 2 g oral für 2 Tage
Tinidazol (Tabletten) 1 x 1 g oral für 5 Tage
Clindamycin (Tabletten) 2 x 300 mg oral für 7 Tage
Clindamycin (Zäpfchen) 100 mg intravaginal für 3 Tage
In der Schwangerschaft oder bei bestehenden Vorerkrankungen kann es zu abweichenden Behandlungen kommen.
Durch den Einsatz dieser Substanzen kann jedoch häufig keine dauerhafte Heilung der BV erzielt werden; dann kommt es zu Rückfällen und zu rezidivierenden Verläufen. Darüber hinaus kann es zu unerwünschten Nebenwirkungen kommen; einige Antibiotika hemmen auch das Wachstum der Laktobazillen, die sich durch die Therapie eigentlich wieder vermehren sollten.
Probiotika bestehen aus lebensfähigen Mikroorganismen, die einen gesundheitlichen Nutzen für den Menschen haben. Zum Einsatz kommen zumeist diverse Laktobazillus-Arten (ausschließlich oder in Kombination), wie zum Beispiel
Sie können geschluckt werden („orale Gabe“) oder etwa als Creme oder Salbe an den Ort der Erkrankung gebracht werden („lokale Gabe“). Bei den lokalen Anwendungen können die Mikroorganismen auch zusammen mit Hormonen verabreicht werden.
Eine Metaanalyse aus dem Jahre 2014 [2] zeigte, dass Probiotika die Heilungsquote der bakteriellen Vaginose deutlich verbessern, insbesondere wenn sie oral gegeben werden.
In einer großen Übersichtsarbeit aus dem Jahre 2019 [3] wurden auch vaginale Probiotika untersucht, deren Wirksamkeit in wissenschaftlichen Studien gezeigt werden konnten: vaginale Probiotika unterstützen nicht nur die Heilung der bakteriellen Vaginose, sondern helfen auch einen Rückfall zu verhindern.
Vaginale Präparate, die Milchsäure enthalten oder Substanzen, die den pH-Wert verbessern, sind ebenfalls geeignet, die Rückfallquote der bakteriellen Vaginose zu senken. Dazu gehört auch ein pflanzliches Polysaccharid („2QR-Komplex“), welches die Anlagerung von Nicht-Laktobazillen hemmt.
[1] J. Paavonen and R. C. Brunham (2018) Bacterial Vaginosis and Desquamative Inflammatory Vaginitis. N Engl J Med 379: 2246
[2] H. Huang, L. Song and W. Zhao (2013) Effects of probiotics for the treatment of bacterial vaginosis in adult women: a meta-analysis of randomized clinical trials. Arch Gynecol Obstet 289: 1225
[3] J. van de Wijgert and M. Verwijs (2019) Lactobacilli-containing vaginal probiotics to cure or prevent bacterial or fungal vaginal dysbiosis: a systematic review and recommendations for future trial designs. BJOG 127: 287